Эксперт раскрыл секреты создания вакцины против коронавируса
- Эксперт раскрыл секреты создания вакцины против коронавируса
- Связанные вопросы и ответы
- Какие этапы проходит разработка вакцины от коронавируса
- Какие технологии используются при создании вакцины против COVID-19
- Как долго может занять процесс разработки и тестирования вакцины на коронавирус
- Какие вызовы стоят перед учеными при создании противовирусного препарата
- Новости проекта
- Журнал Respiratory Research опубликовал третье исследование эффективности вакцинации
- Журнал BMC Medicine опубликовал результаты исследования эффективности вакцинации
- «Спутник V» защищает от повреждения легких, вызванного штаммами дельта и омикрон
- «Спутник V» защищает от дельта-варианта SARS-CoV-2: результаты независимого исследования
- Почему жители России не хотят прививаться от COVID-19?
- Антон Барчук рассказал об исследованиях ИММИ в подкасте «Хорошая практика»
- Материал по результатам препринта об исследовании эффективности вакцинации опубликован в журнале Science
- Вакцинация защищает пациентов с COVID-19 от госпитализации и тяжелого поражения легких: независимое исследование
- Каковы ключевые критерии эффективности и безопасности вакцины от COVID-19
- Как происходит тестирование вакцины на животных и людях
- Как обеспечивается контроль качества и безопасности вакцины в ходе исследований
- Какие результаты уже достигнуты в разработке вакцины от коронавируса
Эксперт раскрыл секреты создания вакцины против коронавируса
Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Одни из самых популярных на сегодняшний день — это рекомбинантные или векторные вакцины. Они изготавливаются на основе вирусов-носителей или вирусных векторов. Как это работает? Вы берете какие-то вирусные частицы, «вычищаете» из них все патогенные составляющие и на их место вставляете нужные вам элементы — генетический материал вируса, против которого изготавливается вакцина. По такому принципу была создана прививка от вирусного гепатита B или ротавирусной инфекции. И по такому же принципу сегодня многие разработчики создают вакцину от COVID-19. В частности, в России векторную вакцину от коронавируса разработали в НИИ эпидемиологии и микробиологии имени Н.Ф. Гамалеи.
Павел Волчков:
«Чем хорош вирусный вектор? Он способен инфицировать клетки только один раз и не может размножаться в организме человека дальше. Такая особенность делает рекомбинантные вакцины довольно безопасными. При этом в качестве вирусного вектора можно использовать буквально любой вирус из библиотеки человеческих патогенов. Выбор зависит от того, для какого заболевания вы изготавливаете вакцину. Потому что одни вирусы лучше заражают мышцы, другие — легкие, третьи — центральную нервную систему. Например, та же вакцина Центра Гамалеи выполнена на аденовирусном векторе».
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
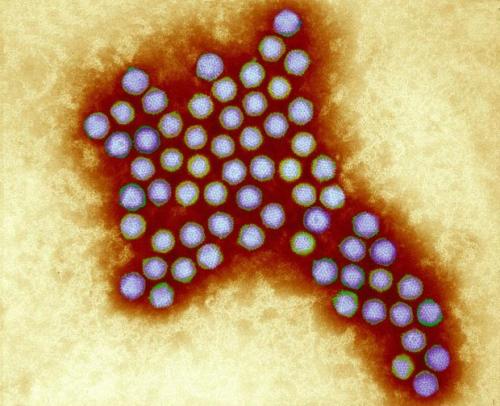
Аденовирус под микроскопом (Фото: Wellcome Images)
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта ClinicalTrials.gov , клинические испытания на людях успешно прошли или проходят более сотни различных вакцин на основе аденовирусных векторов.
Среди главных преимуществ этих вирусов — их естественный механизм взаимодействия с клетками человека. Они способны обеспечивать довольно длительную экспрессию антигена, а это успешно активирует врожденный иммунный ответ.
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
«При всех плюсах, у аденовирусов есть и ряд минусов. Первое — они обладают провоспалительным эффектом. То есть могут чрезмерно драйвить иммунную систему. Проще говоря — вызывать сильный иммунный ответ. Это один из возможных побочных эффектов вообще всех аденовирусных вакцин. Но есть еще один нюанс. Большинство аденовирусов — это естественные патогены человека. Многие из нас сталкивались в течение жизни с аденовирусными инфекциями. А что это значит? Что в крови у таких людей уже есть нейтрализирующие антитела к этому вирусу. Они могут связываться с компонентами вакцины и блокировать ее действие. Поэтому для некоторых из нас такая вакцина будет совершенно неэффективна».
Источник: https://interesnyefakty.com/stati/vazhnost-razrabotki-vakciny-ot-koronavirusa-mnenie-professora
Связанные вопросы и ответы:
1. Каковы основные этапы разработки вакцины от коронавируса
На первом этапе происходит исследование вируса и его распространения, затем начинается создание потенциальных вакцин. Далее идет тестирование на животных и в дальнейшем на добровольцах. После успешного прохождения клинических испытаний вакцина регистрируется и начинается производство. Важно, чтобы весь процесс был скрупулезно проработан и контролируем.
2. Какая технология использовалась при создании вакцины от коронавируса
Для создания вакцины от коронавируса могут использоваться различные технологии, такие как векторные, мРНК-вакцины или вакцины на основе белков. Важно выбрать наиболее эффективный и безопасный метод для борьбы с инфекцией. Например, в случае COVID-19 были успешно применены мРНК-вакцины, что позволило быстро разработать вакцину.
3. Сколько времени обычно занимает разработка вакцины от нового вируса
Обычно разработка вакцины от нового вируса занимает несколько лет. Необходимо провести многоэтапные исследования, испытания на животных и людях, получить разрешение на применение вакцины. Однако в случае пандемии, процесс разработки может быть ускорен за счет финансирования, современных технологий и международного сотрудничества.
4. Какие вызовы могут возникнуть при разработке вакцины от коронавируса
При разработке вакцины от коронавируса могут возникнуть вызовы, такие как нехватка финансирования, трудности с прохождением клинических испытаний, недостаточное количество специалистов. Важно учитывать все возможные риски и проблемы на каждом этапе разработки. Также важно обеспечить прозрачность процесса и безопасность вакцины.
5. Какие преимущества имеет разработка вакцины от коронавируса
Разработка вакцины от коронавируса позволяет предотвратить заражение вирусом, снизить заболеваемость и смертность от COVID-19. Вакцинация способствует формированию коллективного иммунитета и снижает риск распространения инфекции. Кроме того, разработка вакцины может способствовать развитию новых технологий и методов борьбы с инфекционными заболеваниями.
6. Какую роль играют клинические испытания при разработке вакцины от коронавируса
Клинические испытания играют ключевую роль при разработке вакцины от коронавируса. Они позволяют оценить эффективность и безопасность вакцины, определить дозировку и схему введения. Результаты клинических испытаний являются основой для принятия решения о регистрации и массовом применении вакцины. Важно, чтобы испытания проводились строго в соответствии с международными стандартами и этическими принципами.
7. Какие этапы следуют после успешной разработки вакцины от коронавируса
После успешной разработки вакцины от коронавируса следуют этапы ее регистрации, производства и внедрения. Вакцина должна пройти процедуру регистрации и получить разрешение на применение в медицинской практике. Затем начинается производство вакцины в достаточных объемах для вакцинации населения. Важно обеспечить доступность и безопасность вакцины тем, кто нуждается в защите от коронавируса.
Какие этапы проходит разработка вакцины от коронавируса
Фармацевтические компании, занимающиеся разработкой лекарственных препаратов и вакцины от коронавируса SARS-CoV-2, используют как классические технологии, так и современные технологические платформы для создания синтетических вакцин (мРНК-вакцины, субъединичные и пептидные вакцины). Подбор технологической платформы (технологии создания вакцины) является чрезвычайно сложным процессом, во многом определяющим дальнейший процесс исследований. Рассмотрим некоторые из технологий.
Классическая технология разработки вакцины
Они могут создаваться как на основе живых ослабленных возбудителей болезни, так и инактивированных возбудителей, а также на основе более современных технологий, включающих в вакцину фрагменты вирусов/бактерий или анатоксины из обработанных специальным образом токсинов возбудителей. Иммунная система организма реагирует на них и при появлении такого же возбудителя она распознает его и нейтрализует.

Прототип вакцины ChAdOx1 nCoV-19
Вакцины такого рода — бактериальная и вирусная вакцина . Представлены препаратами, содержащими микроорганизмы аттенуированные разными типами воздействий на них. Они имеют существенные недостатки в виде: высокого риска реверсии вирулентности, высокой реактогенности, присутствия вирусов-контаминантов и химических инактиваторов, высокого содержания клеточного балласта, что затрудняет осуществление контроля качества при их производстве.
По сути, это технология создания вакцин первого поколения и тем не менее эта технология в рекомбинации с другими современными технологическими приемами продолжает использоваться. Примером такого подхода является прототип вакцины ChAdOx1 nCoV-19 , которая создана на базе ослабленной версии аденовируса у шимпанзе, в которую добавлена часть генетического кода коронавируса или созданных на платформе других вакцин на основе вирусов гриппа А , кори , везикулярного стоматита , вируса Эбола .
Биосинтетические вакцины
Это вакцины второго поколения — белковая вакцина . В своем большинстве представлены рекомбинантными белками, аминокислотными последовательностями структур бактериального и вирусного белка, которые могут распознаваться иммунной системой человека и вызывать адекватный иммунный ответ. Такая рекомбинантная вакцина лишена недостатков вакцинных препаратов первого поколения и вызывают узко специфичный иммунный ответ.
Несмотря на относительно меньшую эффективность вакцин этого поколения в сравнении с исходным вирусом, что обусловлено меньшей иммуногенностью искусственно созданных участков, комбинированное использование нескольких различных иммуногенов позволяет обеспечить высокий/достаточный иммунный ответ при существенном снижении побочного действия вакцины и ее реактогенности, что является существенным конкурентным преимуществом. Примером может служить вакцина, созданная на базе субъединицы S-белка SARS-CoV-2 — S-Trimer с усилителем иммунной реакции (адъюванта). Поскольку такая вакцина вирусного материала не содержит, спектр ее побочных действий чрезвычайно низок
Еще одной технологической платформой является рекомбинантная экспрессия белков, отвечающих за сборку капсида в вирусных/дрожжевых системах. Установлено, что именно плотноупакованная белковая структура поверхности капсомера и опосредует его высокую иммуногенность. Эта технология позволяет получать вирусоподобные частицы (VLP) , объединенные в структуру, близкую к оригинальному вириону. Функциональные физиологические характеристики VLP, сформированные капсидным белком, индуцируют выработку антител класса IgG , что и явилось базой для создания VLP-вакцин. Иммунизация животных вакциной VLP в эксперименте позволила защитить животных от последующего заражения вирусом. Канадская фарм-компания Medicago еще в марте 2020 года заявила о начале производства вирусоподобных частиц (VLP) коронавируса и ими же разрабатывается VLP-вакцина от коронавируса SARS-CoV-2.
Особого внимания заслуживают синтетические вакцины , создаваемые на различных технологических платформах. Одной из таких является транскрипционная технология с использованием синтетических матричных РНК (мРНК). Создаваемая на базе этой технологии мРНК-вакцина осуществляет кодирование белков-антигенов конкретного инфекционного агента, а иммунная система человека реагирует на них выработкой T-клеточного ответа.
Вакцинные препараты на базе мРНК обладают высоким потенциалом стимулирования T-клеточного ответа по сравнению с вирусными инактивированными и белковыми вакцинами. К преимуществам мРНК технологии можно отнести их способность имитировать естественные вирусные патогены, поскольку синтез мРНК-опосредованных антигенных белков вирусного патогена осуществляется непосредственно в клетках организма человека, где и осуществляются посттрансляционные модификации, аналогичные таковым, происходящим при натуральном жизненном цикле вируса, попадающем в организм. То есть, инъекция, содержащая РНК белка коронавируса, вызовет у человека иммунный ответ, при этом, фактически не заразив его полноценным вирусом.
Какие технологии используются при создании вакцины против COVID-19
⇒ В описываемой в данной статье вакцине (как и в двух других) применяется немодифицированный S-белок коронавируса. Последние исследования говорят о том, что это не самый удачный вариант — достаточно немного изменить конфигурацию белка ( подробнее ) и он гораздо лучше формирует иммунный ответ, но это выяснилось уже после старта разработки этих вакцин, и смена типа белка означала бы начало разработки с нуля, что в условиях гонки, видимо, было не оправдано.
⇒ Требования к участникам:
• Возраст 18-85, ИМТ 18,5-30 по Кетле
• Отрицательные анализы на вирус и антитела к нему, и на стандартный набор госпитального скрининга (ВИЧ, сифилис, гепатиты)
• Не болел ковидом и не было контакта с лицами, им болеющим, а также признаков ОРВИ в последние 14 дней
• Согласие соблюдать надежные методы контрацепции на протяжении всего исследования (6,5 месяцев), причем презервативы таковыми не считаются. Допускается полное воздержание, стерилизация, презерватив со спермицидом или ОК. В случае беременности (своей или партнера для мужчин), надо обращаться к руководителям исследования.
Последний пункт мне совершенно непонятен. Да, некоторые вирусные векторы могут встраивать полезную нагрузку в геном заражаемой клетки, и если при этом вирус заразит половые клетки, то измененное ДНК сможет передаться по наследству, если удачно подгадать момент. Но так делают векторы, основанные на ретровирусах, а тут аденовирусный вектор.
В дикой природе в ДНК клетки встраивает свою генетическую информацию, например, ВИЧ, причем делает это довольно забавно: у него внутри информация хранится в виде РНК, но он тащит с собой в собранном виде, прям внутри капсида фермент — обратную транскрипазу , которая строит по РНК вируса цепочку ДНК, а потом еще один фермент вируса, интеграза, встраивает код вируса в виде ДНК в геном клетки.
Как долго может занять процесс разработки и тестирования вакцины на коронавирус
Победить вирус при помощи фармпрепаратов крайне сложно — лекарства с доказанным действием стоят огромных денег. Но почему при борьбе с такими микроорганизмами возникает так много проблем?
В отличие от антибиотиков широкого спектра действия, которые могут быть использованы для лечения большого количества различных бактериальных инфекций, противовирусные препараты редко работают против нескольких различных микроорганизмов. Например, ремдесивир, первоначально разработанный для лечения гепатита С, был в какой-то момент предложен для лечения COVID-19, но клинические испытания показали , что его молекула действует не так хорошо, как считалось.
Причина, по которой существует мало эффективных антивирусных препаратов широкого спектра действия, заключается в том, что вирусы гораздо более разнообразны, чем бактерии. В отличие от бактерий, вирусы имеют меньше собственных белковых строительных блоков, на которые можно нацелить лекарства.
Чтобы препарат подействовал, он должен сначала достичь своей цели. Это особенно трудно сделать в случае вирусов, потому что они размножаются внутри человеческих клеток, подчиняя себе их механизмы жизнедеятельности. Препарат должен проникнуть внутрь этих инфицированных клеток и воздействовать на процессы, необходимые для нормального функционирования человеческого организма. Неудивительно, что это часто приводит к сопутствующему повреждению клеток человека, которое воспринимается как побочный эффект.
Нацелить лекарство на частицы вируса вне клеток — чтобы не дать им проникнуть в них и реплицироваться — возможно, но трудно осуществимо из-за природы вирусной оболочки. Она прочна и способна сопротивляться негативному воздействию окружающей среды на пути к клетке. Только внутри нее оболочка раскрывается и выбрасывает свое содержимое. Этот процесс может быть слабым местом в жизненном цикле вируса, но условия, при которых возможен этот процесс, очень специфичны.
Лекарства, нацеленные на оболочку вируса, уже разрабатываются, но некоторые из них все еще могут быть токсичными для человека. Еще одна проблема в борьбе с вирусами заключается в том, что некоторые из них, такие как ВИЧ, папилломавирус и герпес, могут переключаться в спящий режим. В этом состоянии инфицированные клетки не производят новые частицы. Генетическая информация — единственная вирусная часть, присутствующая в клетках. Лекарства, мешающие репликации или раскрытию оболочки вируса, не действуют, потому что нацеливаться во время «спячки» им не на что.
По материалам The Conversation.
Какие вызовы стоят перед учеными при создании противовирусного препарата

Вместе с Медицинским институтом им. Березина Сергея изучаем эффективность вакцинации от COVID-19 в естественных условиях — насколько эффективны российские вакцины против тяжелого течения болезни и разных штаммов коронавируса.
Новости проекта

Журнал Respiratory Research опубликовал третье исследование эффективности вакцинации
Статья вышла 10 октября. Ученые Европейского университета и Медицинского института им. Березина Сергея (МИБС) оценили, насколько эффективно российские вакцины защищают от поражения легких во время волн COVID-19, вызванных дельтой и омикроном.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

22 сентября журнал BMC Public Health выпустил статью исследователей Европейского университета и Медицинского института им. Березина Сергея (МИБС). Ученые изучали, как российские вакцины защищают от заражения дельта-вариантом SARS-CoV-2. Согласно результатам, эффективность «Спутника V» составила 56%, «Спутника Лайт» — 49%, «ЭпиВакКороны» — -58%, «Кови Вака» — 40%.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Журнал BMC Medicine опубликовал результаты исследования эффективности вакцинации
Публикация вышла 20 сентября в BMC Medicine — ведущем журнале серии BMC. Ученые Европейского университета и Медицинского института им. Березина Сергея (МИБС) рассчитали эффективность российских вакцин в реальной практике во время третьей волны пандемии, вызванной дельта-вариантом коронавируса.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

«Спутник V» защищает от повреждения легких, вызванного штаммами дельта и омикрон
Исследователи Европейского университета и Медицинского института им. Березина Сергея (МИБС) рассчитали эффективность российских вакцин против поражения легких во время волн COVID-19, вызванных дельтой и омикроном. Эффективность двух доз «Спутника V» составила 56 %, а трех — 71 %. «ЭпиВакКорона» не показала эффективности.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

«Спутник V» защищает от дельта-варианта SARS-CoV-2: результаты независимого исследования
Исследователи Европейского университета в Санкт-Петербурге и Медицинского института им. Березина Сергея рассчитали эффективность российских вакцин против симптоматической коронавирусной инфекции во время вспышки, вызванной дельта-вариантом. «Спутник V» защищает от дельта-варианта — эффективность вакцины составила 58%. В реальности эффективность еще выше, так как на этот расчетный показатель влияет число неучтенных переболевших.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Почему жители России не хотят прививаться от COVID-19?
В августе ученые ученые Европейского университета, Медицинского института им. Березина Сергея, Первого меда в Санкт-Петербурге и Тарусской больницы опубликовали результаты независимого исследования эффективности вакцинации против COVID-19. «Коммерсантъ» опубликовал материал об исследовании «Спутника V» и основных причинах отказа от вакцинации.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Антон Барчук рассказал об исследованиях ИММИ в подкасте «Хорошая практика»
Директор Института междисциплинарных медицинских исследований Антон Барчук стал гостем подкаста «Хорошая практика». Выпуск посвящен эпидемиологическим исследованиям.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Материал по результатам препринта об исследовании эффективности вакцинации опубликован в журнале Science
В журнале Science Американской ассоциации содействия развитию науки опубликована статья о независимом исследовании эффективности вакцинации.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Вакцинация защищает пациентов с COVID-19 от госпитализации и тяжелого поражения легких: независимое исследование
При заражении SARS-CoV-2 людям, привитым «Спутником V», реже требуется госпитализация. Эффективность вакцинации на этом этапе составляет 81%, то есть шансы тяжелого течения COVID-19 снижаются в 5 раз.
Каковы ключевые критерии эффективности и безопасности вакцины от COVID-19
Фото: pixabay.com/ruСотрудник Института биологии ТюмГУ Николай Карпов предложил тестировать вакцины от коронавируса на кошках. По его словам, именно эти животные являются наиболее восприимчивыми к болезни, поэтому могут стать прекрасной «моделью» для исследований. «Вечерняя Москва» поговорила с экспертами, объяснившими, как происходит тестирование вакцин и насколько этично апробировать их на кошках.
— Есть несколько стандартов, так называемых платформ, по которым сегодня создают вакцины, — объяснил ведущий научный сотрудник Института клинической экспериментальной медицины, профессор вирусологии Александр Чепурнов . — Самая простая — инактивированная, когда вирус или бактерия убивается формалином. К сожалению, такой подход далеко не всегда оказывается рабочим: у разных возбудителей свои способы ухода от иммунного ответа, есть такие, от которых создать вакцину не удается. Например, вирус иммунодефицита, гепатит С. У Эболы, кстати, тоже были механизмы, блокировавшие иммунный ответ.
— Допустим, мы создали вакцину. Как ее тестировать ?
— Наиболее правильный способ — создать несколько вариантов, начать тестировать и посмотреть, какой даст лучший результат. Для этого нам требуется восприимчивое, чувствительное к возбудителю животное. То есть такое животное, которое после введения вируса или бактерии заболеет, а лучше всего — в лабораторных условиях умрет. В итоге получается система, когда мы можем ввести вакцину животному, затем заразить и посмотреть, умрет оно или нет. Конечно, есть другие подходы, но они косвенные.
— Как выбрать нужное животное?
— Как я уже говорил, оно должно быть восприимчиво к возбудителю. У американцев и китайцев, например, есть специально выведенные мыши со встроенным рецептором, на который садится вирус. У нас таких мышей и моделей, к сожалению, нет. Но вот появились данные, что к коронавирусу наиболее восприимчивы и погибают от него кошки, так что они идеально подходят на роль подопытных. Делается все таким образом: берем несколько групп животных и вакцинируем каждую из них одним из разработанных препаратов, отдельной группе не вводим ничего. Если контрольная группа погибает, а одна из экспериментальных нет, выбираем ту, где препарат сработал лучше всего.
— И уже этот препарат вводится людям?
— Нет, дальше начинается более детальная проверка. Препарат вводится другой группе животных, например, обезьянам по определенной установленной методике, и проводятся исследования относительно того, не вызывает ли вакцина онкологию, воспалительные процессы, другие нежелательные реакции. Только в том случае, если тестирование проходит благополучно, начинаются испытания на добровольцах.
Зоозащитница, юрист, президент фонда «Забытые животные» Анастасия Комагина оказалась категорически против проведения тестов на кошках. По ее словам, это не только неэтично, но и неэффективно:
— От заболеваний кошек люди не умирают, так что как это можно экстраполировать на людей, я не понимаю. У этих животных есть свой коронавирус, но даже они погибают не от него, а от изменений в организме, которые могут перерождаться в FIP кошек (инфекционный перитонит — прим. «ВМ» ). Так что, на мой взгляд, подобные исследования не просто абсолютно неэтичны, но и недостоверны. К тому же, насколько мне известно, некоторые ученые уже начали тестирование вакцин на людях, поэтому смысла в подобных издевательствах не вижу. Разве что кто-то очень не любит кошек и хочет посмотреть, как они умирают. Нормальные исследователи сначала проводят опыты на клетках, затем, если идет положительный ответ, уже переводят их в плоскость испытаний на более высоких организмах. Да и сейчас уже начали переливать плазму переболевших людей больным, что дает хорошие результаты.
— Существуют какие-то правовые механизмы, способные не допустить опытов над кошками?
— Сложно сказать. Надо смотреть, насколько научны эти эксперименты. Если условный Иван Иванов вдруг решил, что изобрел какую-то вакцину и надо срочно начинать тестирования, то это может быть квалифицировано как жестокое обращение с животными. Но, если этим занимаются серьезные институты, они могут подвести любой эксперимент под рамки закона. Хотя мне кажется, что нормальный ученый такой чушью заниматься не будет.
Как происходит тестирование вакцины на животных и людях
В России производится около 90 видов вакцин. По показателям безопасности и эффективности отечественные вакцины календаря прививок соответствуют требованиям ВОЗ. Они получили международное признание. Хотя, конечно, любая из них (как и каждая зарубежная) требует дальнейшего совершенствования. К сожалению, ни одна из вакцин не является абсолютно безопасной. Все они обладают определенной степенью реактогенности, которая лимитирована нормативной документацией на препараты.
Побочные явления, которые могут возникать при введении вакцин, весьма разнообразны. Факторы, способствующие возникновению побочных реакций, можно разделить на 4 группы.
1. Нарушения условий производства вакцин, правил транспортирования и хранения препаратов.
2. Игнорирование противопоказаний к применению вакцин, нарушение процедуры вакцинации, изменение способа введения, дозы препарата и т. д.
3. Свойства самой вакцины, ее антигенов, добавок и примесей.
4. Особенности состояния привитого.
Первые две группы нарушений носят спорадический характер и устранимы при повышении требований к производителям вакцин и медицинским работникам, проводящим вакцинацию. Гарантией предотвращения производственных и процедурных нарушений является строгое соблюдение установленных требований, норм и правил.
Вакцины содержат примеси и различного рода вещества, добавляемые в препарат с целью стабилизации, консервации или сорбции антигена, в частности гетерологичные белки (яичный белок, бычий сывороточный альбумин), мертиолят, формальдегид, антибиотики, гидроокись алюминия и пр. Это породило ряд мифов о плохом качестве вакцин и целое движение, направленное против вакцинации как у нас в стране, так и за рубежом. Последствия такого движения, поддержанного средствами массовой информации, всем хорошо известны.
Предельные концентрации примесей и добавок в вакцинах указаны в нормативной документации на препараты. Они не превышают лимиты, установленные Всемирной организацией здравоохранения. Все серии вакцин проходят контроль непосредственно на производстве и в контрольной лаборатории предприятия. Кроме того, серии вакцин проходят контроль по производственным протоколам и выборочный лабораторный контроль в Национальном органе контроля - ГИСК им. Л. А. Тарасовича. Такой тройной контроль обеспечивает надлежащее качество производственных серий вакцин.
Вакцины – это эффективный способ предотвратить распространение заболеваний. В России производится около 90 видов вакцин, которые соответствуют требованиям ВОЗ по безопасности и эффективности.
Тестирование вакцин на животных
Первым шагом в разработке вакцины является тестирование на животных. Вакцины подвергаются испытаниям на различных животных, таких как мыши, крысы, козы, свиньи и другие, чтобы проверить их безопасность и эффективность.
В ходе тестирования вакцин на животных оцениваются следующие параметры:
- Безопасность: отсутствие побочных эффектов, вызванных введением вакцины;
- Эффективность: способность вакцины предотвращать или уменьшать распространение заболевания;
- Продолжительность действия: продолжительность действия вакцины после ее введения;
- Токсичность: наличие токсических веществ в вакцине.
Тестирование вакцин на людях
После успешного тестирования вакцины на животных, она подвергается испытаниям на людях. Это называется клиническими испытаниями.
Клинические испытания включают в себя:
- Малое количество участников: 20-50 человек;
- Мониторинг безопасности: наблюдение за участниками за безопасностью и возможными побочными эффектами;
- Мониторинг эффективности: оценка эффективности вакцины в предотвращении или уменьшении распространения заболевания.
Если вакцина проходит клинические испытания успешно, она получает разрешение на использование в медицинской практике.
Побочные явления после вакцинации
Все вакцины имеют определенный уровень реактогенности, лимитированный нормативной документацией на препараты.
Побочные явления, которые могут возникать при введении вакцин, могут быть связаны с нарушениями условий производства, транспортировки и хранения препаратов, игнорированием противопоказаний, свойствами самой вакцины, ее антигенов, добавок и примесей, а также особенностями состояния привитого.
Гарантией предотвращения производственных и процедурных нарушений является строгое соблюдение установленных требований, норм и правил.
Как обеспечивается контроль качества и безопасности вакцины в ходе исследований
Евгений Разумный / Ведомости
Новая версия вакцины от коронавируса «Спутник», которая актуализирована под штаммы, циркулирующие сейчас в мире, подготовлена и проходит клинические испытания. Об этом заявил министр здравоохранения Михаил Мурашко на саммите «Россия – Африка» (цитата по ТАСС).
Последний вариант «Спутника» будет применяться для ревакцинации, пояснил глава Минздрава. По его мнению, Россия сможет поставлять обновленный препарат в страны Африки. Он также напомнил, что вакцина «Спутник» экспортировалась в более чем в 70 государств мира.
Как уточнил директор Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи, разработавшего препарат, Александр Гинцбург, вакцина будет работать против ХВВ-штаммов, которые в том числе циркулируют и в Африке (цитата по «Известиям»). Производство актуализированного «Спутника», по его словам, начнется после того, как центр получит от Минздрава необходимое финансирование. Обновленной вакциной можно будет прививать и взрослых, и подростков, отметил Гинцбург. Выводы об эффективности актуализированной вакцины можно будет сделать только по итогам клинических исследований, сказал «Ведомостям» эпидемиолог Василий Власов. Точная дата их завершения пока неизвестна.
Всемирная организация здравоохранения (ВОЗ) в своем еженедельном отчете от 27 июля сообщала, что с 26 июня по 23 июля 2023 г. почти в половине стран не было зарегистрировано ни одного заболевшего коронавирусом (в 112 из 234). В нем также говорится о снижении заболеваемости в большинстве регионов за исключением государств западной части Тихого океана. Больше всего новых случаев коронавируса за 28 дней было выявлено в Южной Корее (593 000 случаев), Бразилии (48 500), Австралии (35 800), следует из отчета.
Несмотря на снижение заболеваемости коронавирусом в мире, директор по развитию аналитической компании RNC Pharma Николай Беспалов считает, что экспортный потенциал у российской вакцины есть. Он объясняет это тем, что в ряде регионов вакцинация проводилась в сравнительно скромных объемах. Вместе с этим, по мнению Беспалова, повторить максимумы продаж 2021 г. будет практически невозможно «Это будет довольно нишевой продукт», – сказал он «Ведомостям».
По данным федерального оперштаба по борьбе с инфекцией, число заболевших коронавирусом и умерших от него в последний месяц в России падало. В период с 26 июня по 2 июля выявлено 1639 новых случаев, умерло 86 человек, с 3 по 9 июля – 1453 заболевших и 66 умерших, с 10 по 16 июля – 1138 заболевших и 57 умерших, с 17 по 23 июля – 1110 заболевших и 42 умерших.
Российский Минздрав 21 июля предложил перейти от массовой вакцинации от коронавируса к иммунизации людей из групп риска, объяснив свое решение «стабилизацией эпидемической ситуации» и «формированием высокого уровня коллективного иммунитета». Соответствующий проект приказа ведомства был опубликован на портале проектов нормативных правовых актов. К уязвимым категориям граждан относятся ранее не болевшие или не привитые совершеннолетние, граждане в возрасте от 60 лет и те, кто страдает хроническими заболеваниями (ВИЧ, туберкулезом, онкологией, сахарным диабетом, а также аутоиммунными, сердечно-сосудистыми заболеваниями и болезнями бронхолегочной системы). Согласно документу, ревакцинацию против коронавируса нужно будет проводить не ранее, чем через год после предыдущей прививки от этого вируса. Предполагается, что приказ будет действовать до 1 марта 2030 г.
Эпидемиолог Власов считает переход к иммунизации только россиян из группы риска обоснованным. Предпосылок для серьезного подъема заболеваемости коронавирусом в осенне-зимний период пока нет, считает он. Точные прогнозы эпидемиолог давать не стал, лишь допустил, что вирусы COVID-19 и гриппа будут циркулировать в пределах уровня прошлого года. При этом, по его мнению, есть риски роста распространения других вирусов. «Очень многие инфекции в результате пандемии коронавируса были подавлены, а теперь поднимаются. И никто не может надежно предположить, что будет происходить с этими инфекциями – с гриппом, сифилисом, туберкулезом и другими», – сказал эпидемиолог.
Какие результаты уже достигнуты в разработке вакцины от коронавируса
При разработке вакцин против COVID-19 используют несколько подходов . Приводим их ключевые характеристики:
1. Инактивированные вакцины – содержат убитый вирус. Помимо него они могут включать специальные вещества для стимуляции иммунного ответа. Такие вакцины провоцируют реакцию иммунной системы на несколько компонентов коронавируса, включая главную мишень – белок-шип, или spike-белок. Обычно их вводят внутримышечно.
Примеры: китайские вакцины Sinopharm и Sinovac; российская вакцина «КовиВак».
2. Живые аттенуированные вакцины – содержат ослабленный вирус. Он размножается в организме и активирует иммунный ответ, но в норме не вызывает заболевания. Вирус можно ослабить, выращивая его при неблагоприятных условиях либо специально изменив генетическую последовательность. При этом остается риск , что вирус снова окрепнет и спровоцирует болезнь, поэтому перед применением такие вакцины долго и тщательно изучают.
Живые вакцины запускают ответ сразу ко многим компонентам вируса, создавая стойкий иммунитет. Их можно вводить интраназально – на слизистые, стимулируя защиту в месте проникновения вируса. Несколько живых вакцин против COVID-19 сейчас исследуют на животных, и лишь одна проходит клинические испытания на людях.
Примеры: COVI-VAC от Codagenix (США).
3. Субъединичные (рекомбинантные белковые) вакцины – включают отдельные вирусные белки. В случае с SARS-CoV-2 это spike-белок, его часть – рецептор-связывающий домен (RBD), либо вирусоподобные частицы (VLP).
Такие вакцины обычно вводят внутримышечно. К этому виду относится большая часть вакцин, которые сейчас проходят клинические испытания.
Примеры: «ЭпиВакКорона» (зарегистрирована в России и Туркмении); Novavax (США).
4. Векторные вакцины – содержат ген SARS-CoV-2 в составе безвредного вируса-носителя. Вирусный вектор играет роль шаттла, который доставляет в клетку чужие гены. Если таким способом ввести гены коронавируса, клетка начнет производить его белки. Недостатком векторных вакцин может стать иммунитет к вирусу-носителю, уже существующий в организме. Если вакцинированный раньше встречался с этим вирусом, иммунная система разрушит препарат, и эффективность вакцинации снизится.
Разрабатывают 2 варианта таких вакцин: в одних вирус-носитель может размножаться в организме, а в других нет. К первому типу относят векторы на основе вирусов гриппа, кори, везикулярного стоматита (VSV) и болезни Ньюкасла (NDV). Ко второму – вакцины на основе аденовирусного вектора и модифицированной вакцины Анкара (MVA) от вируса оспы. Большинство из них сконструированы так, чтобы стимулировать ответ организма на spike-белок. Некоторые вакцины находятся на поздней стадии клинических испытаний.
Примеры: «Спутник V» (доступна в России и, по всей видимости, появится в Турции, Бразилии, Сербии, Боливии, Венгрии); ChAdOx1 (разрешена в Евросоюзе, Великобритании, Индии); CanSino Biologics (разрешена для ограниченного использования в Китае); Janssen от Johnson & Johnson (США).
5. ДНК-вакцины – содержат молекулы ДНК вируса, которые несут информацию о его белках. Проникнув в клетки, они сливаются с ядерной ДНК и становятся инструкцией для производства вирусного spike-белка. В результате клетки вместе со своими белками начинают вырабатывать чужеродный, привлекая к нему внимание иммунной системы.
Такие вакцины можно получить в больших количествах, но их не ввести в организм без специального прибора – электропоратора. Он производит электрические импульсы и делает клетки более проницаемыми для молекул ДНК. ДНК-вакцин мало, но часть из них уже прошла первый этап клинических испытаний.
Примеры: INO-4800 (США); AG0301-COVID19 (Япония).
6. РНК-вакцины – содержат РНК вируса, заключенную в оболочку из липидов. Благодаря этому вакцины легко проникают в клетки организма. В отличие от ДНК, вирусным РНК не нужно встраиваться в геном – последовательность белка будет считываться непосредственно с них. При этом РНК-вакцины возникли совсем недавно и пока недостаточно исследованы. Их производство должно стать дешевым и быстрым, но может потребовать очень низких температур для хранения. Некоторые РНК-вакцины против SARS-CoV-2 уже доступны.
Примеры: Pfizer-BioNTech COVID-19 (разрешена в США, Канаде, Великобритании и Евросоюзе), Moderna COVID-19 (разрешена в США и Евросоюзе).